1. RANGKUMAN GAS IDEAL
DEFINISI GAS IDEAL
Gas merupakan satu dari tiga wujud zat dan walaupun wujud ini merupakan bagian tak terpisahkan dari studi kimia, bab ini terutama hanya akan membahasa hubungan antara volume, temperatur dan tekanan baik dalam gas ideal maupun dalam gas nyata, dan teori kinetik molekular gas, dan tidak secara langsung kimia. Bahasan utamanya terutama tentang perubahan fisika, dan reaksi kimianya tidak didisuksikan. Namun, sifat fisik gas bergantung pada struktur molekul gasnya dan sifat kimia gas juga bergantung pada strukturnya. Perilaku gas yang ada sebagai molekul tunggal adalah contoh yang baik kebergantungan sifat makroskopik pada struktur mikroskopik.
a. Sifat gasSifat-sifat gas dapat dirangkumkan sebagai berikut.
- Gas bersifat transparan.
- Gas terdistribusi merata dalam ruang apapun bentuk ruangnya.
- Gas dalam ruang akan memberikan tekanan ke dinding.
- Volume sejumlah gas sama dengan volume wadahnya. Bila gas tidak diwadahi, volume gas akan menjadi tak hingga besarnya, dan tekanannya akan menjadi tak hingga kecilnya.
- Gas berdifusi ke segala arah tidak peduli ada atau tidak tekanan luar.
- Bila dua atau lebih gas bercampur, gas-gas itu akan terdistribusi merata.
- Gas dapat ditekan dengan tekanan luar. Bila tekanan luar dikurangi, gas akan mengembang.
- Bila dipanaskan gas akan mengembang, bila didinginkan akan mengkerut.
Tekanan didefinisikan gaya per satuan luas, jadi tekanan = gaya/luas.
Dalam SI, satuan gaya adalah Newton (N), satuan luas m2, dan satuan tekanan adalah Pascal (Pa). 1 atm kira-kira sama dengan tekanan 1013 hPa.
1 atm = 1,01325 x 105 Pa = 1013,25 hPa
Namun, dalam satuan non-SI unit, Torr, kira-kira 1/760 dari 1 atm, sering digunakan untuk mengukur perubahan tekanan dalam reaksi kimia (www.chem-is-try.org)
b. Volume dan tekanan
Fakta bahwa volume gas berubah bila tekanannya berubah telah diamati sejak abad 17 oleh Torricelli dan filsuf /saintis Perancis Blase Pascal (1623-1662). Boyle mengamati bahwa dengan mengenakan tekanan dengan sejumlah volume tertentu merkuri, volume gas, yang terjebak dalam tabung delas yang tertutup di salah satu ujungnya, akan berkurang. Dalam percobaan ini, volume gas diukur pada tekanan lebih besar dari 1 atm.
Boyle membuat pompa vakum menggunakan teknik tercangih yang ada waktu itu, dan ia mengamati bahwa gas pada tekanan di bawah 1 atm akan mengembang. Setelah ia melakukan banyak percobaan, Boyle mengusulkan persamaan (6.1) untuk menggambarkan hubungan antara volume V dan tekanan P gas. Hubungan ini disebut dengan hukum Boyle. PV = k (suatu tetapan)
Penampilan grafis dari percobaan Boyle dapat dilakukan dengan dua cara. Bila P diplot sebagai ordinat dan V sebagai absis, didapatkan hiperbola
c. Volume dan temperatur
Setelah lebih dari satu abad penemuan Boyle ilmuwan mulai tertarik pada hubungan antara volume dan temperatur gas. Mungkin karena balon termal menjadi topik pembicaraan di kotakota waktu itu. Kimiawan Perancis Jacques Alexandre César Charles (1746-1823), seorang navigator balon yang terkenal pada waktu itu, mengenali bahwa, pada tekanan tetap, volume gas akan meningkat bila temperaturnya dinaikkan. Hubungan ini disebut dengan hukum Charles, walaupun datanya sebenarnya tidak kuantitatif. Gay-Lussac lah yang kemudian memplotkan volume gas terhadap temperatur dan mendapatkan garis lurus (Gambar 6.2). Karena alasan ini hukum Charles sering dinamakan hukum Gay-Lussac. Baik hukum Charles dan hukum Gay-Lussac kira-kira diikuti oleh semua gas selama tidak terjadi pengembunan.
Pembahasan menarik dapat dilakukan dengan hukum Charles. Dengan mengekstrapolasikan plot volume gas terhadap temperatur, volumes menjadi nol pada temperatur tertentu. Menarik bahwa temperatur saat volumenya menjadi nol sekiatar -273°C (nilai tepatnya adalah -273.2 °C) untuk semua gas. Ini mengindikasikan bahwa pada tekanan tetap, dua garis lurus yang didapatkan dari pengeplotan volume V1 dan V2 dua gas 1 dan 2 terhadap temperatur akan berpotongan di V = 0.
Fisikawan Inggris Lord Kelvin (William Thomson (1824-1907)) megusulkan pada temperatur ini temperatur molekul gas menjadi setara dengan molekul tanpa gerakan dan dengan demikian volumenya menjadi dapat diabaikan dibandingkan dengan volumenya pada temperatur kamar, dan ia mengusulkan skala temperatur baru, skala temperatur Kelvin, yang didefinisikan dengan persamaan berikut.
273,2 + °C = K
Kini temperatur Kelvin K disebut dengan temperatur absolut, dan 0 K disebut dengan titik nol absolut. Dengan menggunakan skala temperatur absolut, hukum Charles dapat diungkapkan dengan persamaan sederhana
V = bT (K)
dengan b adalah konstanta yang tidak bergantung jenis gas.
Menurut Kelvin, temperatur adalah ukuran gerakan molekular. Dari sudut pandang ini, nol absolut khususnya menarik karena pada temperatur ini, gerakan molekular gas akan berhenti. Nol absolut tidak pernah dicapai dengan percobaan. Temperatur terendah yang pernah dicapai adalah sekitar 0,000001 K.
Avogadro menyatakan bahwa gas-gas bervolume sama, pada temperatur dan tekanan yang sama, akan mengandung jumlah molekul yang sama (hukum Avogadro; Bab 1.2(b)). Hal ini sama dengan menyatakan bahwa volume real gas apapun sangat kecil dibandingkan dengan volume yang ditempatinya. Bila anggapan ini benar, volume gas sebanding dengan jumlah molekul gas dalam ruang tersebut. Jadi, massa relatif, yakni massa molekul atau massa atom gas, dengan mudah didapat (www.chem-is-try.org)
Gas pada dasarnya sangat rumit jika untuk dipelajari secara konservatif. Karena itu perlu penyederhanaan tersendiri. Dengan menganggap gas sebagai gas ideal, kamu akan menyederhanakan dalam mempelajari gas.Gas ideal adalah gas yang memenuhi beberapa syarat tertentu. Gas ideal memenuhi beberapa kriteria sebagai berikut:1. Jumlah partikel gas banyak sekali tetapi tidak ada gaya tarik menarik antar partikel2. Semua partikel bergerak dengan acak3. Ukuran gas sangat kecil bila dibanding dengan ukuran wadah, jadi ukuran gas diabaikan4. Setiap tumbukan yang terjadi bersifat lenting sempurna5. Partikel gas terdistribusi merata pada seluruh ruang dalam wadah6. Partikel gas memenuhi hukum newton tentang gerakDalam kehidupan nyata sebenarnya tidak ada gas ideal, ini hanya permisalan saja.
d. Persamaan gas ideal
Esensi ketiga hukum gas di atas dirangkumkan di bawah ini. Menurut tiga hukum ini, hubungan antara temperatur T, tekanan P dan volume V sejumlah n mol gas dengan terlihat.
Tiga hukum Gas
Hukum Boyle: V = a/P (pada T, n tetap)
Hukum Charles: V = b.T (pada P, n tetap)
Hukum Avogadro: V = c.n (pada T, P tetap)
Jadi, V sebanding dengan T dan n, dan berbanding terbalik pada P. Hubungan ini dapat digabungkan menjadi satu persamaan:
V = RTn/P
atau
PV = nRT
R adalah tetapan baru. Persamaan di atas disebut dengan persamaan keadaan gas ideal atau lebih sederhana persamaan gas ideal.
Nilai R bila n = 1 disebut dengan konstanta gas, yang merupakan satu dari konstanta fundamental fisika. Nilai R beragam bergantung pada satuan yang digunakan. Dalam sistem metrik, R = 8,2056 x10–2 dm3 atm mol-1 K-1. Kini, nilai R = 8,3145 J mol-1 K-1 lebih sering digunanakan.
Beberapa istilah kimia dalam persamaan gas ideal:
1. Massa atom relatif (Ar) adalah perbandingan massa atom suatu unsur terhadap massa atom unsur lain.
2. Massa molekul relatif (Mr) adalah jumlah seluruh massa atom relatif (Ar) dan atom-atom penyusun suatu senyawa.
3. Mol (n) adalah perbandingan massa (m) suatu partikel terhadap massa relatifnya (Ar atau Mr)
4. Bilangan Avogadro (NA) adalah bilangan yang menyatakan jumlah partikel dalam sam mol (NA = 6,02 x 1023 partikel/mol). Hubungan antara mol (n), massa (m), dan jumlah partikel (N): R = konstanta gas umum = 8,31 J/mol K atau R = 0,082 L atm/mol K k = (konstanta Boltzmann= 1,38 x 1023 J/K) a. mol dan massa 1 mol= 6,022 x 1023 molekul 6,022 x 1023 juga disebut dengan bilangan avogadro (NA).
2. GAS IDEAL DALAM ILMU KIMIA
Dalam ilmu kimia adapun gas gas ideal yang keterkaitan, yaitu hukum hukum gas :
Hukum-hukum gas ideal diantaranya Hukum boyle, Hukum Charles, Hukum Gay lussac. Teori kinetik gas memberikan jembatan antara tinjauan gas secara mikroskopik dan makrokospik. Hukum-hukum gas seperti hukum Boyle, Charles, dan Gay Lussac, menunjukkan hubungan antara besaran-besaran makrokospik dari berbagai macam proses serta perumusannya. Kata kinetik berasal dari adanya anggapan bahwa molekul-molekul gas selalu bergerak.
Hukum-Hukum Gas Ideal
Hukum Boyle
Grafik hubungan volume dan tekanan gas pada suhu konstan (isotermal).
Hukum Charles
Grafik hubungan volume dan suhu gas pada tekanan konstan (isobarik)
Hukum Gay Lussac
Hukum Boyle-Gay Lussac
Grafik hubungan volume dan tekanan gas pada suhu konstan (isotermal).
Hukum Charles
Grafik hubungan volume dan suhu gas pada tekanan konstan (isobarik)
Hukum Gay Lussac
Hukum Boyle-Gay Lussac
Hukum Boyle dikemukakan oleh fisikawan Inggris yang bernama Robert Boyle. Hasil percobaan Boyle menyatakan bahwa apabila suhu gas yang berada dalam bejana tertutup dipertahankan konstan, maka tekanan gas berbanding terbalik dengan volumenya. Untuk gas yang berada dalam dua keadaan keseimbangan yang berbeda pada suhu konstan, diperoleh persamaan sebagai berikut.
p1V1 = p2V2
Keterangan:
p1 : tekanan gas pada keadaan 1 (N/m2)
p2 : tekanan gas pada keadaan 2 (N/m2)
V1 : volume gas pada keadaan 1 (m3)
V2 : volume gas pada keadaan 2 (m3)
p2 : tekanan gas pada keadaan 2 (N/m2)
V1 : volume gas pada keadaan 1 (m3)
V2 : volume gas pada keadaan 2 (m3)
Jika dibuat grafik, maka akan menghasilkan sebuah kurva yang disebut kurva isotermal. Perhatikan gambar diatas. Kurva isotermal merupakan kurva yang bersuhu sama.
Hukum Charles dikemukakan oleh fisikawan Prancis bernama Jacques Charles. Charles menyatakan bahwa jika tekanan gas yang berada dalam bejana tertutup dipertahankan konstan, maka volume gas sebanding dengan suhu mutlaknya. Untuk gas yang berada dalam dua keadaan seimbang yang berbeda pada tekanan konstan, diperoleh persamaan sebagai berikut.
Keterangan:
V1 : volume gas pada keadaan 1 (m3)
V2 : volume gas pada keadaan 2 (m3)
T1 : suhu mutlak gas pada keadaan 1 (K)
T2 : suhu mutlak gas pada keadaan 2 (K)
V2 : volume gas pada keadaan 2 (m3)
T1 : suhu mutlak gas pada keadaan 1 (K)
T2 : suhu mutlak gas pada keadaan 2 (K)
Apabila hubungan antara volume dan suhu pada hukum Charles kita lukiskan dalam grafik, maka hasilnya tampak seperti pada gambar diatas. Kurva yang terjadi disebut kurva isobarik yang artinya bertekanan sama.
Hukum Gay Lussac dikemukakan oleh kimiawan Perancis bernama Joseph Gay Iussac. Gay Lussac menyatakan bahwa jika volume gas yang berada dalam bejana tertutup dipertahankan konstan, maka tekanan gas sebanding dengan suhu mutlaknya. Untuk gas yang berada dalam dua keadaan seimbang yang berbeda pada volume konstan, diperoleh persamaan sebagai berikut.
Keterangan:
T1 : suhu mutlak gas pada keadaan 1 (K)
T2 : suhu mutlak gas pada keadaan 2 (K)
p1 : tekanan gas pada keadaan 1 (N/m2)
p2 : tekanan gas pada keadaan 2 (N/m2)
T2 : suhu mutlak gas pada keadaan 2 (K)
p1 : tekanan gas pada keadaan 1 (N/m2)
p2 : tekanan gas pada keadaan 2 (N/m2)
Grafik hubungan tekanan dan suhu gas pada volume konstan (isokhorik)
Apabila hubungan antara tekanan dan suhu gas pada hukum Gay Lussac dilukiskan dalam grafik, maka hasilnya tampak seperti pada gambar diatas. Kurva yang terjadi disebut kurva isokhorik yang artinya volume sama.
Apabila hukum Boyle, hukum Charles, dan hukum Gay Lussac digabungkan, maka diperoleh persamaan sebagai berikut.
Persamaan di atas disebut hukum Boyle-Gay Lussac. Kita telah mempelajari hukum-hukum tentang gas, yaitu hukum Boyle, Charles, dan Gay Lussac. Namun, dalam setiap penyelesaian soal biasanya menggunakan hukum Boyle-Gay Lussac. Hal ini disebabkan hukum ini merupakan gabungan setiap kondisi yang berlaku pada hukum-hukum gas ideal.
3. FENOMENA GAS IDEAL
Penerapan sederhana gas ideal yang terjadi di dalam kehidupan secara tidak di sengaja.
- Ban motor menjadi kempes jika lama tidak digunakan
Nah kenapa ban motor anda kempes jika lama tidak digunakan? Ternyata ini dapat di jawab dengan logis melalui formula gas ideal ini.
Ketika anda sering menggunakan motor, motor akan mejadi panas. Bukan hanya pada mesin saja yang panas, namun juga terjadi pada body dan juga pada ban. ban motor malah sering bersentuhan dengan aspal yang tentunya panas sekali. Nah pada saat ban ini panas berarti suhu pada ban ini meningkat bukan? Ketika suhu meningkat otomatis tekanan di dalam ban juga ikut meningkat juga. Sesuai dengan formula gas ideal di atas.
Ketika motor lama tidak anda gunakan menyebabkan suhu pada motor menjadi dingin, begitu juga dengan ban. bila anda menyimpan motor anda di rumah di lantai batu maka ban akan lebih dingin lagi. Hal ini menyebabkan suhu pada ban menurun. Ketika suhu ban ini turun otomatis tekanan di dalam ban berkurang. Hal inilah yang menyebabkan ban motor anda kempes setelah lama tidak di gunakan.
Bagaimana sudah faham? Sangat logis sekali bukan?
Ketika anda sering menggunakan motor, motor akan mejadi panas. Bukan hanya pada mesin saja yang panas, namun juga terjadi pada body dan juga pada ban. ban motor malah sering bersentuhan dengan aspal yang tentunya panas sekali. Nah pada saat ban ini panas berarti suhu pada ban ini meningkat bukan? Ketika suhu meningkat otomatis tekanan di dalam ban juga ikut meningkat juga. Sesuai dengan formula gas ideal di atas.
Ketika motor lama tidak anda gunakan menyebabkan suhu pada motor menjadi dingin, begitu juga dengan ban. bila anda menyimpan motor anda di rumah di lantai batu maka ban akan lebih dingin lagi. Hal ini menyebabkan suhu pada ban menurun. Ketika suhu ban ini turun otomatis tekanan di dalam ban berkurang. Hal inilah yang menyebabkan ban motor anda kempes setelah lama tidak di gunakan.
Bagaimana sudah faham? Sangat logis sekali bukan?
- Botol menjadi kempes setelah di masuki air panas
Pernahkan anda memasukkan air panas kedalam botol? Misalnya anda pergi kekebun dengan membawa sebuah kopi dan kopi tersebut anda masukan ke dalam sebuah botol. Tanpa anda sadari botol yang berisi air kopi hangat itu mengalami kempes, seperti tersedot bukan? Jika anda tidak mengetahui itu tentu saja anda akan mengabaikan begitu saja. Bila anda penasaran kenapa hal itu bisa terjadi? Ternyata ini bisa di jelaskan di dalam teori gas ideal.
Pada saat anda memasukkan kopi hangat pada botol kemudian menutupnya segera dan pergi kekebun. Selama anda di perjalanan suhu pada kopi hangat anda sedikit-sedikit akan turun menyesuaikan dengan lingkungan di sekitarnya. Turunnya suhu pada kopi ini menyebabkan rumus gas ideal bekerja. Yaitu adalah ketika suhu turun menyebabkan tekanan di dalam botol menjadi turun. Nah hal itulah yang menyebabkan botol kopi anda menjadi kempes atau seperti tersedot.
Bagaimana? Logis bukan? Bila anda ingin mencoba bereksperiment sendiri untuk membuktikan dengan jelas di mata dan kepala anda secara langsung anda bisa mencoba cara sederhana yang juga pernah saya lakukan. Alat yang perlu anda persiapkan hanyalah sebuah botol aqua, terserah ukuran berapa saja. Selanjutnya masaklah nasi dengan menggunaka magicom atau ketika orang tua anda menanak nasi tunggulah hingga airnya mendidih dan mengeluarkan uap melalui cerobong uap magicom.
Ketika sudah mendidih dan uap keluar dari cerobong. Bukalah botol anda lalu arahkan mulut botol pada cerobong uap nasi tadi. Pastikan uap air masuk pada botol anda. setelah kira-kira cukup segera tutup botol anda dengan rapat. lalu diamkan beberapa saat, lihatlah perubahan pada botol anda sekarang!!! Botol kempes bukan hanya panas yang di akibatkan dari suhu uap air, tetapi juga dari hukum gas ideal ini. sekarang anda telah bisa membuktikan sendiri dengan cara sederhana mengenai gas ideal ini
Pada saat anda memasukkan kopi hangat pada botol kemudian menutupnya segera dan pergi kekebun. Selama anda di perjalanan suhu pada kopi hangat anda sedikit-sedikit akan turun menyesuaikan dengan lingkungan di sekitarnya. Turunnya suhu pada kopi ini menyebabkan rumus gas ideal bekerja. Yaitu adalah ketika suhu turun menyebabkan tekanan di dalam botol menjadi turun. Nah hal itulah yang menyebabkan botol kopi anda menjadi kempes atau seperti tersedot.
Bagaimana? Logis bukan? Bila anda ingin mencoba bereksperiment sendiri untuk membuktikan dengan jelas di mata dan kepala anda secara langsung anda bisa mencoba cara sederhana yang juga pernah saya lakukan. Alat yang perlu anda persiapkan hanyalah sebuah botol aqua, terserah ukuran berapa saja. Selanjutnya masaklah nasi dengan menggunaka magicom atau ketika orang tua anda menanak nasi tunggulah hingga airnya mendidih dan mengeluarkan uap melalui cerobong uap magicom.
Ketika sudah mendidih dan uap keluar dari cerobong. Bukalah botol anda lalu arahkan mulut botol pada cerobong uap nasi tadi. Pastikan uap air masuk pada botol anda. setelah kira-kira cukup segera tutup botol anda dengan rapat. lalu diamkan beberapa saat, lihatlah perubahan pada botol anda sekarang!!! Botol kempes bukan hanya panas yang di akibatkan dari suhu uap air, tetapi juga dari hukum gas ideal ini. sekarang anda telah bisa membuktikan sendiri dengan cara sederhana mengenai gas ideal ini
- Konsep gerakan piston dalam mesin
Kenapa motor bisa berjalan? Karena ada mesin. Kenapa mesin bisa berputar? Ada yang bisa menjawab? Anak teknik mesin mungkin bisa menjawabnya yaa.. tapi sebenarnya anak sekolahan SMA itu sudah bisa menjawab hal ini. terutama berdasarkan pelajaran sehingga dapat menjawab dengan logis.
Konsep pada mesin sebenarnya sederhana sekali. Menggunakan teori gas ideal. Dimana bila volume di perkecil secara otomatis tekanan menjadi besar dan menyebabkan suhu menjadi naik. Ketika piston bergerak maju mundur melakukan suatu pekerjaan yang berfungsi untuk mengubah volume tabung / slinder piston agar mendapatkan suhu yang tinggi. pada kondisi suhu yang tinggi bila di semprotkan kabut minyak minyak solar / bensin dapat menyebabkan ledakan di dalam tabung piston. Ledakan ini menyebabkan piston bergerak mundur kembali seperti semula.
Pada inti yang sebenarnya adalah hanya untuk menaikkan suhu ruangan agar dapat terjadi pembakaran, dengan cara mengecilkan volume sehingga mendapatkan tekanan yang tinggi. pada tekanan tinggi otomatis suhu akan naik. Sesuai dengan konsep rumus gas ideal bahwa ketika tekanan di naikkan, maka suhu akan naik juga.
Hal yang menyebabkan mesin panas bukan hanya gesekan yang terjadi, namun akibat dari tekan yang tinggi tersebut. Pada umumnya di luar bagian mesin (body) biasanya ada pendingin untuk mengurangi panas pada mesin. Jadi sekarang anda sudah tau kan kenapa mesin bisa berputar? Sederhana konsepnya ya?
Tempak dari kulit rambai :ngakak
Konsep pada mesin sebenarnya sederhana sekali. Menggunakan teori gas ideal. Dimana bila volume di perkecil secara otomatis tekanan menjadi besar dan menyebabkan suhu menjadi naik. Ketika piston bergerak maju mundur melakukan suatu pekerjaan yang berfungsi untuk mengubah volume tabung / slinder piston agar mendapatkan suhu yang tinggi. pada kondisi suhu yang tinggi bila di semprotkan kabut minyak minyak solar / bensin dapat menyebabkan ledakan di dalam tabung piston. Ledakan ini menyebabkan piston bergerak mundur kembali seperti semula.
Pada inti yang sebenarnya adalah hanya untuk menaikkan suhu ruangan agar dapat terjadi pembakaran, dengan cara mengecilkan volume sehingga mendapatkan tekanan yang tinggi. pada tekanan tinggi otomatis suhu akan naik. Sesuai dengan konsep rumus gas ideal bahwa ketika tekanan di naikkan, maka suhu akan naik juga.
Hal yang menyebabkan mesin panas bukan hanya gesekan yang terjadi, namun akibat dari tekan yang tinggi tersebut. Pada umumnya di luar bagian mesin (body) biasanya ada pendingin untuk mengurangi panas pada mesin. Jadi sekarang anda sudah tau kan kenapa mesin bisa berputar? Sederhana konsepnya ya?
Tempak dari kulit rambai :ngakak
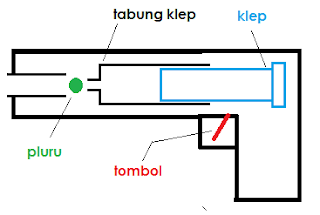
- Tembak mainan
Siapa yang tahu bagaiamana cara kerja dari tembak mainan? Di dalam tembak mainan ada namanya klep dan tabung klepnya. Klep ini seperti halnya piston. Ketika tembak mainan di tarik kebelakang untuk menambahkan peluru, otomatis klep ini akan ikut kebelakang. Namun klep akan berhenti karena ada kunci yang menahan. Nah ketika tombol pada tembak ini ditekan, maka membuka kunci klep tadi dan klep secara cepat kembali ke posisi semula. Kedika klep bergerak cepat tersebut menyebabkan perubahan volume pada tabung klep tersebut. Volume menjadi kecil tentu saja tekanan menjadi besar di dalam tabung kelp. Tekanan ini mendesak peluru sehingga peluru mejadi terbang keluar akibat dari tekanan udara yang di timbulkan dari klep tsb.

- Pompa sepeda
Contoh sederhana lagi tentang gas ideal. Pernahkah anda memompa sepeda atau motor anda dengan pompa manual? Pernahkan anda memegang body pompa setelah anda selesai menggunakan pompa? Jika anda pernah memegang pompa tersebut anda akan merasakan panas. Yup benar, panas! Kenapa?
Saat anda memompa sepeda, udara dari dalam pompa di paksa masuk pada ban sepeda anda. tahukah anda bahwa pentil sepeda itu lubangnya kecil. Saat anda memaksa udara dari pompa menuju ban menyebabkan udara di dalam pompa menjadi tertekan karena harus bergantian masuk pada ban melalui lubang pentil yang sempit. Tekanan yang tinggi di dalam pompa ini menyebabkan udara yang keluar dari mulut pentil sangat cepat hingga menyebabkan ada bunyi “ngiik” saat anda memompa. Ini juga termasuk salahsatu contoh sederhana dari rumus Debit (Q = Av). Nah tekanan ini lah yang menyebabkan suhu pada body pompa menjadi naik.
saat anda memompa. Ini juga termasuk salahsatu contoh sederhana dari rumus Debit (Q = Av). Nah tekanan ini lah yang menyebabkan suhu pada body pompa menjadi naik.
Saat anda memompa sepeda, udara dari dalam pompa di paksa masuk pada ban sepeda anda. tahukah anda bahwa pentil sepeda itu lubangnya kecil. Saat anda memaksa udara dari pompa menuju ban menyebabkan udara di dalam pompa menjadi tertekan karena harus bergantian masuk pada ban melalui lubang pentil yang sempit. Tekanan yang tinggi di dalam pompa ini menyebabkan udara yang keluar dari mulut pentil sangat cepat hingga menyebabkan ada bunyi “ngiik”
 saat anda memompa. Ini juga termasuk salahsatu contoh sederhana dari rumus Debit (Q = Av). Nah tekanan ini lah yang menyebabkan suhu pada body pompa menjadi naik.
saat anda memompa. Ini juga termasuk salahsatu contoh sederhana dari rumus Debit (Q = Av). Nah tekanan ini lah yang menyebabkan suhu pada body pompa menjadi naik.
4. CONTOH SOAL
1. Gas ideal berada di dalam suatu ruang pada mulanya mempunyai volume V dan suhu T. Jika gas dipanaskan sehingga suhunya berubah menjadi 5/4 T dan tekanan berubah menjadi 2P maka volume gas berubah menjadi…
Pembahasan
Diketahui :
Volume awal (V1) = V
Suhu awal (T1) = T
Suhu akhir (T2) = 5/4 T
Tekanan awal (P1) = P
Tekanan akhir (P2) = 2P
Ditanya : Volume akhir (V2)
Jawab :
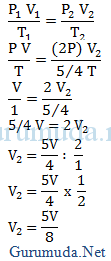 Volume gas berubah menjadi 5/8 kali volume awal.
Volume gas berubah menjadi 5/8 kali volume awal.
Pembahasan
Diketahui :
Volume awal (V1) = V
Suhu awal (T1) = T
Suhu akhir (T2) = 5/4 T
Tekanan awal (P1) = P
Tekanan akhir (P2) = 2P
Ditanya : Volume akhir (V2)
Jawab :
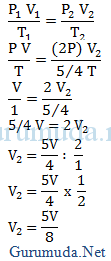 Volume gas berubah menjadi 5/8 kali volume awal.
Volume gas berubah menjadi 5/8 kali volume awal.
2. Volume 2 mol gas pada suhu dan tekanan standar (STP) adalah…
Pembahasan
Diketahui :
Jumlah mol gas (n) = 2 mol
Suhu standar (T) = 0 oC = 0 + 273 = 273 Kelvin
Tekanan standar (P) = 1 atm = 1,013 x 105 Pascal
Konstanta gas umum (R) = 8,315 Joule/mol.Kelvin
Ditanya : Volume gas (V)
Jawab :
Hukum Gas Ideal (dalam jumlah mol, n)
 Volume 2 mol gas adalah 44,8 liter.
Volume 2 mol gas adalah 44,8 liter.
Volume 1 mol gas adalah 45,4 liter / 2 = 22,4 liter.
Jadi volume 1 mol gas, baik gas oksigen atau helium atau argon atau gas lainnya, adalah 22,4 liter.
Pembahasan
Diketahui :
Jumlah mol gas (n) = 2 mol
Suhu standar (T) = 0 oC = 0 + 273 = 273 Kelvin
Tekanan standar (P) = 1 atm = 1,013 x 105 Pascal
Konstanta gas umum (R) = 8,315 Joule/mol.Kelvin
Ditanya : Volume gas (V)
Jawab :
Hukum Gas Ideal (dalam jumlah mol, n)
 Volume 2 mol gas adalah 44,8 liter.
Volume 2 mol gas adalah 44,8 liter.Volume 1 mol gas adalah 45,4 liter / 2 = 22,4 liter.
Jadi volume 1 mol gas, baik gas oksigen atau helium atau argon atau gas lainnya, adalah 22,4 liter.
3. 4 liter gas oksigen bersuhu 27°C pada tekanan 2 atm (1 atm = 105 Pa) berada dalam sebuah wadah. Jika konstanta gas umum R = 8,314 J.mol−1.K−1dan bilangan avogadro NA 6,02 x 1023 molekul, maka banyaknya molekul gas oksigen dalam wadah adalah…
Pembahasan
Diketahui :
Volume gas (V) = 4 liter = 4 dm3 = 4 x 10-3 m3
Suhu gas (T) = 27oC = 27 + 273 = 300 Kelvin
Tekanan gas (P) = 2 atm = 2 x 105 Pascal
Konstanta gas umum (R) = 8,314 J.mol−1.K−1
Bilangan Avogadro (NA) = 6,02 x 1023
Ditanya : Banyaknya molekul gas oksigen dalam wadah (N)
Jawab :
Konstanta Boltzmann :
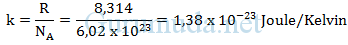 Hukum Gas Ideal (dalam jumlah molekul, N)
Hukum Gas Ideal (dalam jumlah molekul, N)
 Dalam 1 mol gas oksigen, terdapat 1,93 x 1023 molekul oksigen.
Dalam 1 mol gas oksigen, terdapat 1,93 x 1023 molekul oksigen.
Pembahasan
Diketahui :
Volume gas (V) = 4 liter = 4 dm3 = 4 x 10-3 m3
Suhu gas (T) = 27oC = 27 + 273 = 300 Kelvin
Tekanan gas (P) = 2 atm = 2 x 105 Pascal
Konstanta gas umum (R) = 8,314 J.mol−1.K−1
Bilangan Avogadro (NA) = 6,02 x 1023
Ditanya : Banyaknya molekul gas oksigen dalam wadah (N)
Jawab :
Konstanta Boltzmann :
 Dalam 1 mol gas oksigen, terdapat 1,93 x 1023 molekul oksigen.
Dalam 1 mol gas oksigen, terdapat 1,93 x 1023 molekul oksigen.
4. Sebuah bejana berisi gas neon (Ne, massa atom = 20 u) pada suhu dan tekanan standar (STP mempunyai volume 2 m3. Tentukan massa gas neon!
Diketahui :
Massa atom neon = 20 gram/mol = 0,02 kg/mol
Suhu standar (T) = 0oC = 273 Kelvin
Tekanan standar (P) = 1 atm = 1,013 x 105 Pascal
Volume (V) = 2 m3
Ditanya : massa (m) gas neon
Jawab :
Pada suhu dan tekanan standar (STP), 1 mol gas apa saja, termasuk gas neon, mempunyai volume 22,4 liter = 22,4 dm3 = 0,0448 m3. Dengan demikian, dalam volume 2 m3 terdapat berapa mol gas neon ?
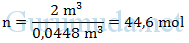 Dalam volume 2 m3 terdapat 44,6 mol gas neon.
Dalam volume 2 m3 terdapat 44,6 mol gas neon.
Massa atom relatif gas neon adalah 20 gram/mol. Ini artinya dalam 1 mol terdapat 20 gram atau 0,02 kg gas neon. Karena dalam 1 mol terdapat 0,02 kg gas neon maka dalam 44,6 mol terdapat (44,6 mol)(0,02 kg/mol) = 0,892 kg = 892 gram gas neon.
Diketahui :
Massa atom neon = 20 gram/mol = 0,02 kg/mol
Suhu standar (T) = 0oC = 273 Kelvin
Tekanan standar (P) = 1 atm = 1,013 x 105 Pascal
Volume (V) = 2 m3
Ditanya : massa (m) gas neon
Jawab :
Pada suhu dan tekanan standar (STP), 1 mol gas apa saja, termasuk gas neon, mempunyai volume 22,4 liter = 22,4 dm3 = 0,0448 m3. Dengan demikian, dalam volume 2 m3 terdapat berapa mol gas neon ?
Massa atom relatif gas neon adalah 20 gram/mol. Ini artinya dalam 1 mol terdapat 20 gram atau 0,02 kg gas neon. Karena dalam 1 mol terdapat 0,02 kg gas neon maka dalam 44,6 mol terdapat (44,6 mol)(0,02 kg/mol) = 0,892 kg = 892 gram gas neon.
5. Sebuah gas ideal menjalani proses isobarik sehingga suhu kelvinnya naik menjadi 6 kali semula. Maka volumennya akan berubah menjadi .... kali semula
A. 8
B. 6
C. 4
D. 2
E. 1
Pembahasan
Karena melakukan proses isobarik tekanan tetap.
A. 8
B. 6
C. 4
D. 2
E. 1
Pembahasan
Karena melakukan proses isobarik tekanan tetap.
Diketahui :
V1 = V
V1 = V
T1 = T
T2 = 6 T1
Ditanya berapa volume setelah mengalami perubahan suhu menjadi 6 kali dari semula?
Jawab :
Memakai rumus gas ideal yaitu P1V1 = P2V2
T1 T2
Karena isobarik maka tekanan tetap jadi tidak diikuitkan dalam perhitungan kali ini.
V1 = V2
T1 T2
V = V2
T 6T
V2 = 6 V
Jadi volumenya berubah menjadi 6 kali volume semula B. 6
6. Gas dalam ruangan tertutup bersuhu 27°C, tekanan 3 atm dan volumennya 2L. Apabila gas dipanaskan sampai 57°C dan tekanan naik 1 atm, maka volume gas berubah menjadi ...
A. 2 L
B. 1,80 L
C. 1.65 L
D. 1.20 L
E. 0,80 L
Pembahasan
Diketahui :
T1 = 27°C = 300°K
A. 2 L
B. 1,80 L
C. 1.65 L
D. 1.20 L
E. 0,80 L
Pembahasan
Diketahui :
T1 = 27°C = 300°K
P1 = 3 atm
V1 = 2L
T2 = 57°C = 330°K
P2 = 4 atm
Ditanya berapa volume setelah gas dibakar ?
Jawab :
Memakai rumus gas ideal yaitu P1V1 = P2V2
T1 T2
3 atm x 2L = 4 atm x V2
300°K 330°K
1980 = 1200 V2
V2 = 1.65 L
Jadi volumenya berubah menjadi C. 1,65 L
7. Berapa tekanan gas, jika volumennya 60L, jumlah mol (n) = 3 mol dan mempunyai suhu 27°C? (R = 8,315 J/mol.K)
A. 2,39 atm
B. 2,18 atm
C. 1,89 atm
D. 1,47 atm
E. 1,24 atm
A. 2,39 atm
B. 2,18 atm
C. 1,89 atm
D. 1,47 atm
E. 1,24 atm
Pembahasan
Diketahui :
V = 60L = 60 dm3 = 60x10-3 m3
n = 3 mol
T = 27°C = 300°K
R = 8,315 J/mol.K
Ditanya berapa tekanan gas tersebut?
Jawab :
Memakai rumus gas ideal PV = nRT
P 60x10-3 m3 = 3 mol x 8,315 J/mol.K x 300°K
P 60x10-3 m3 = 7483,5 J
P = 7483,5 J / 60x10-3 m3
P = 124,725 x103
P = 1,24725 x105 Pascal
P = 1,24 atm
P 60x10-3 m3 = 3 mol x 8,315 J/mol.K x 300°K
P 60x10-3 m3 = 7483,5 J
P = 7483,5 J / 60x10-3 m3
P = 124,725 x103
P = 1,24725 x105 Pascal
P = 1,24 atm
